「第5章:ファーマコゲノミクスとバイオマーカー」では、ファーマコゲノミクスな, UGT1A1, 免疫チェックポイント阻害薬などを解説します。
Q21.ファーマコゲノミクスとは なんですか?
A.ファーマコゲノミクスは「ゲノム薬理学」と訳し、個人の「薬に対する反応」と「遺伝情報の特性」との関係性を研究する学問のことです。
解説
ファーマコゲノミクスとは
ファーマコゲノミクスはpharmacogenomicsの日本語読みで、訳すと「ゲノム薬理学」となります。
もともとは薬を意味するファーマ(pharma)と遺伝子を意味するゲノム(genome)を合わせた造語で、「薬に対する反応」と関連する「遺伝情報(DNAおよびRNA)の特性」を研究する学問を意味します。
薬に対する反応=薬物応答
われわれの体は、体内に入ってきた薬物に対してさまざまな反応を起こします。
この一連の反応のことを「薬物応答」といいます。
薬物応答は、吸収や代謝、効果や副作用、排泄など複数の過程があります。
また、薬物応答には個人差があり、その個人差は薬物応答にかかわる遺伝情報(具体的にはDNAおよびRNAのタイプや変異)により規定されている場合があります。ということは、ある遺伝子のタイプや変異を調べることで、薬物応答を予想できる可能性があるのです。
ファーマコゲノミクスによる成果
ファーマコゲノミクス研究の成果として、「薬物応答に関連する遺伝子のタイプを調べることで、抗がん薬の副作用を予測し、薬の投与量を調節する」ということが、実際のがん診療現場で行われています。
また、腫瘍で生じる遺伝子異常を調べることで、抗がん薬の効果を予測できるがんもあります。
ファーマコジェネティクスとは
ファーマコゲノミクスと似た言葉に、ファーマコジェネティクス(pharmacogenetics)があります。
ファーマコジェネティクスはファーマコゲノミクスの一部で「薬理遺伝学」と訳し、ファーマコゲノミクスのうち、薬物応答と関連するDNA配列の定義に関する研究が主体となっています。
(佐々木治一郎)
動画での解説
Q22.がんの再発のしやすさを予測するがんゲノム検査がありますか?
A.すべてのがんに共通の、再発のしやすさを予測するがんゲノム検査はまだありません。
しかし、がんゲノム検査でわかった遺伝情報で予測できるがんもあります。
解説
がんの再発は予測できるのか
手術後や治療後の再発を、がんの遺伝子変異などのゲノム情報で予測する試みは、以前から盛んに行われてきました。現時点で、すべてのがんに共通するような再発予測ゲノム情報は存在しません。
しかし、がんのもつ特定の遺伝子異常が再発にかかわる可能性はあり、実際に臨床応用されているものもあります。
また、「遺伝性腫瘍症候群」の原因遺伝子変異を「生殖細胞系列変異(Q11参照)」としてもつ場合は、もたない場合に比べて再発するリスクが高くなることが知られています。
がんの再発のしやすさと予後因子
がんの再発のしやすさは、がんの種類や進行具合、治療の程度などさまざまな要因により変化します。
同一進行度、同一がんに対して十分で確実な治療が行われても、ある一定の頻度でがんが再発することがあります。
この場合のがんの再発のしやすさとは、がんの質の悪さを意味しています。
このような観点から、がんの再発のしやすさを測る一つの尺度として「予後因子」というものが探索されてきました。
予後因子には性別や年齢、喫煙率などの患者背景や、病理組織型などがありますが、がんによっては、がん細胞のもつ特定の遺伝子異常も、予後因子になることが報告されています。
がんの再発のしやすさの予測と治療の最適化
「予後因子」として遺伝子異常が規定されているようながんでは、予後良好と判定されればしなくてもよい治療を省略できる可能性があります。予後不良と判定されれば、より強力な治療やその遺伝子異常に合致した最適な治療を追加で行うことが検討される場合があります。
(佐々木治一郎)
用語解説
●遺伝性腫瘍症候群:がんの原因となる遺伝子の変異が、親から子へと伝わり、遺伝的にがんにかかりやすくなる疾患群。
動画での解説
Q23.抗がん薬の「効く」「効かない」を見分けるがんゲノム検査がありますか?
A.抗がん薬の一つである分子標的薬が効く、遺伝子の変化を見分けられるがんゲノム検査があります。
解説
分子標的薬の効果を予測するゲノム検査
分子標的薬は「特定の分子」に対して効果を発揮する薬です(Q14参照)。
特定の分子は遺伝子の変化にともなって現れます。
そのため、分子標的薬の対象となる遺伝子の変化を検出する目的で、ゲノム検査を実施します。
遺伝子の変化には生殖細胞系列変異と体細胞変異がありますが(Q11~13参照)、現時点で前者は「血液」、後者は「がんの組織」から調べることができます。
血液中の白血球に含まれるDNAは生殖細胞のDNAを反映しますが(Q32参照)、がん細胞のDNAとは異なります。
しかし、最近では血液からも体細胞変異を検出する技術も確立されつつあります(Q20参照)。
従来の抗がん薬の効果を予測するゲノム検査は?
現状では、従来の抗がん薬(殺細胞性抗がん薬)の効果を予測するゲノム検査はありません。一方で、殺細胞性抗がん薬においても、効果にかかわる分子が複数報告されています。
多くのがんで用いられている抗がん薬のシスプラチンや5-FUでは、それぞれERCC1とチミジル酸合成酵素(TS)という酵素の発現が低い患者さんで効果があることが示唆されています。
しかし、使用できる抗がん薬の種類は多くないため、これらの薬剤は基本的には標準治療として対象の患者さんすべてに投与されています。
免疫チェックポイント阻害薬の効果を予測するゲノム検査に関しては、Q25を参照してください。
(谷本 梓)
動画での解説
Q24.抗がん薬の副作用の程度を予測する がんゲノム検査がありますか?
A.副作用が強く起こる可能性があるゲノムの多型を測定する検査があります。
解説
薬の代謝と副作用
薬によっては、同じ量を投与されても、患者さんによって効果や副作用が異なることが明らかになっています。
特に副作用に関しては「薬の代謝」が関係します。この「薬を代謝する能力」には大きな個人差があります。
薬は主に肝臓で不活性化された後、最終的に尿中または便中に排泄されます。
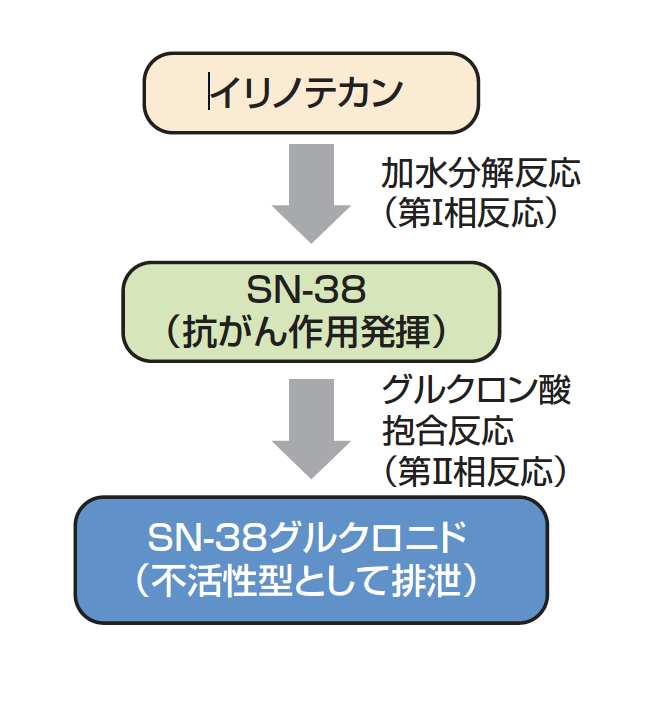
この肝臓での薬の代謝は「第I相反応」と「第II相反応」という2つのステップがあり、前者は酸化、還元、加水分解反応など、後者は抱合反応が行われます。
そして、肺がん、大腸がん、胃がん、子宮頸がん、卵巣がんなどに用いられている抗がん薬であるイリノテカンは「代謝する能力」によって副作用が大きく異なります。
イリノテカンによる副作用の出現を予測できる遺伝子
イリノテカンはSN-38(活性代謝物)に代謝された後に、グルクロン酸抱合を受けて不活性化されます。
この抱合反応を主に触媒するのはグルクロン酸転移酵素(UGT)であり、UGTの一つであるUGT1A1の遺伝子には、約110種類以上の多型(Q5参照)が知られています。
UGT1A1遺伝子の多型の中の数種類の遺伝子では、イリノテカンの代謝が著明に低下することで骨髄抑制や下痢など重篤な副作用の発生頻度が高いことが明らかになっています。
現在、UGT1A1遺伝子多型の判定は保険適用となっており、血液検体から取り出したDNAを用いて調べることができます。
(谷本 梓)
動画での解説
用語解説
●不活性化:薬の作用がなくなること。
●加水分解反応:化合物が水と反応することにより起こる分解反応。
●抱合反応:薬物に水がくっつくこと(水に溶けやすくなる)。
Q25.がんの種類にかかわらず、抗がん薬の効果を予測するがんゲノム検査が ありますか?
A.抗がん薬の一つである免疫チェックポイント阻害薬では、がんの種類を問わずに効果が期待できるゲノムの特徴を調べる検査があります。
解説
MSI-Highのがん(MSIが高いがん)と免疫チェックポイント阻害薬
DNAのところどころには、マイクロサテライト(塩基配列の繰り返しが短いもの)がみられ、DNA複製時に誤り (エラー) が生じやすいことが知られています。
DNA複製時のエラーは、ミスマッチ修復(MMR)タンパク質などによって修復されますが、MMR機能が欠損しているとマイクロサテライトが異常な反復回数を示すことがあります。
これをマイクロサテライト不安定性(MSI)といいます(Q29参照)。
正常な細胞でMMR機能が欠損した結果、DNA複製時のエラーが蓄積されてがん化する場合があります。
これを「MSI-Highのがん(MSIが高いがん)」と呼びます。
MSI-HighのがんはMSI-High以外のがんと比べて、遺伝子変異による異物が多いため免疫細胞(T細胞)の攻撃を受けやすく、そのため、T細胞を再活性化させる免疫チェックポイント阻害薬によって、MSI-Highのがんは高い治療効果が期待できます。
MSI-Highのがんは臓器非特異的
MSI-Highのがんは多岐にわたるがんで報告されており、臓器非特異的です。
がんの組織から抽出したDNAのマイクロサテライトの反復部位を解析することでMSI-Highを確認することが可能であり、標準治療が終了して免疫チェックポイント阻害薬の適応にならなかった固形がんの患者さんにとって治療の選択肢が広がりました。
分子標的薬と臓器非特異的な治療
一方で、分子標的薬においても臓器非特異的な遺伝子変異が治療の対象になり得ることが明らかになってきました。
例えば、NTRK融合遺伝子は肺、大腸、乳腺など多くの固形がんで認められ、分子標的薬(TRK阻害薬)が高い効果を示すことが報告されています。
わが国では2019年6月に、NTRK融合遺伝子を調べる検査とTRK阻害薬が保険承認されました。
(谷本 梓)
動画での解説
用語解説
●臓器非特異的:特定の臓器だけでなく多種類の臓器が対象になること。
●固形がん:骨髄やリンパ節などの造血器以外から発生するがんのこと。
造血器から発生するがんは「血液がん」。
